Este là gì? Công thức cấu tạo và tính chất hóa học của este cùng các bài tập liên quan.
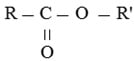
Este là hợp chất hữu cơ quan trọng có nhiều ứng dụng trong đời sống. Hãy cùng Nguyễn Tất Thành khám phá chi tiết về Este qua bài viết sau.
- Boss là gì? Con sen là gì? Nguồn gốc trend boss và con sen
- Điệp từ là gì? Điệp ngữ là gì? Cách phân biệt điệp từ (điệp ngữ) và lặp từ trong tiếng Việt
- DDD là gì? Destroy Dick December là gì? Trào lưu thỏa mãn hay hủy hoại bản thân
- Những lời chúc ngủ ngon độc đáo, ngọt ngào, và lãng mạn để gửi tới người thân, bạn bè, người yêu.
- Danh bạ Taxi Trà Vinh – Số điện thoại và giá cước
1. Khái niệm và danh pháp
Ví dụ về các hợp chất este bao gồm etyl axetat và isoamyl axetat. Este được tạo ra khi nhóm OH của axit cacboxylic được thay thế bằng nhóm OR.
Bạn đang xem: Este là gì? Công thức cấu tạo và tính chất hóa học của este cùng các bài tập liên quan.
Các este đơn chức có công thức chung RCOOR’, với R là gốc hydrocarbon hoặc H và R’ là gốc hydrocarbon.
Este được hình thành từ axit bão hòa đơn không bão hòa mạch hở kết hợp với rượu bão hòa đơn vòng mạch hở, có công thức phân tử CnH2nO2 (có n từ 2 trở lên).
Tên của este có dạng RCOOR’, trong đó tên este bao gồm tên bazơ R’ cộng với tên bazơ axit RCOO (có hậu tố ‘at’).
Ví dụ: CH3COOC2H5: etyl axetat; CH2=CH-COOCH3: metyl acrylat; …
2. Phân loại este
Este được phân loại dựa trên đặc điểm của gốc hydrocarbon và số nhóm cacboxyl, bao gồm: este bão hòa, este không bão hòa, este đơn chức, este đa chức và nhiều loại khác.
- Este được tạo ra khi axit đơn chức (RCOOH) kết hợp với rượu đơn chức (R’OH), có công thức chung RCOOR’. Nếu cả R và R’ đều là gốc bão hòa thì công thức của este là CnH2nO2.
3. Công thức cấu tạo
Este là hợp chất được hình thành khi nhóm -OH trên nhóm carboxyl của axit cacboxylic được thay thế bằng nhóm -OR.
Công thức cấu tạo của este đơn giản được biểu diễn như sau:
Este là sản phẩm có nguồn gốc từ axit cacboxylic. Các dẫn xuất khác của axit cacboxylic có cấu trúc sau:

4. Tính chất vật lý của este
Este thường xuất hiện ở dạng lỏng hoặc rắn trong điều kiện bình thường và ít tan trong nước. Chúng có điểm sôi và độ hòa tan trong nước thấp hơn các axit có khối lượng mol tương đương hoặc số lượng nguyên tử cacbon.
Ví dụ: CH3CH2CH2COOH có nhiệt độ sôi là 163,5°C và dễ tan trong nước.
Sự khác biệt về độ hòa tan và điểm sôi giữa este và axit cồn chủ yếu là do este không có khả năng hình thành liên kết hydro giữa các phân tử của nó và khả năng hình thành liên kết hydro với nước cũng rất kém.
Este thường có mùi thơm đặc trưng: isoamyl axetat có mùi chuối chín, etyl butirate và etyl propionat có mùi dứa, geranyl axetat có mùi hoa hồng,…
5. Tính chất hóa học của este
Este có thể bị thủy phân khi tiếp xúc với môi trường axit hoặc bazơ.
Thí nghiệm: Cho 2 ml etyl axetat vào mỗi ống nghiệm. Thêm vào ống thứ nhất 1 ml dung dịch H2SO4 20%, vào ống thứ hai 1 ml dung dịch NaOH 30%. Chất lỏng trong cả hai ống sẽ tách thành hai lớp. Lắc đều và đun sôi nhẹ (có thể đun cách thủy) khoảng 5 phút. Chất lỏng trong ống nghiệm thứ nhất vẫn xếp thành lớp, trong khi ống nghiệm thứ hai trở nên đồng nhất.
Giải thích:
– Phản ứng xảy ra ở ống nghiệm thứ nhất:
.jpg)
Do phản ứng thuận nghịch, este vẫn còn và tạo thành hai lớp chất lỏng.
– Phản ứng xảy ra ở ống nghiệm thứ hai:
CH3COOC2H5 + NaOH → CH3COONa + C2H5OH
Vì phản ứng là một chiều nên este đã phản ứng hoàn toàn. Phản ứng thủy phân este trong dung dịch kiềm còn được gọi là phản ứng xà phòng hóa. Ngoài ra, este còn tham gia phản ứng tạo gốc hiđrocacbon.
6. Ứng dụng của este trong đời sống
- Nhờ khả năng hòa tan nhiều chất nên một số este được dùng làm dung môi để tách và chiết các chất hữu cơ (etyl axetat), sơn (butyl axetat),…
- Este polyme được dùng để sản xuất các loại nhựa như poly (vinyl axetat), poly (metyl methacrylat),…
- Este thơm, không độc được dùng làm chất tạo hương trong công nghiệp thực phẩm (benzyl formate, ethyl formate,…), mỹ phẩm (linaly acetate, geranyl acetate,…),…
7. Cách pha chế
Xem thêm : Momo trap lover của làng ví điện tử công khai tình mới khiến Gojek, Highlands ganh tị
Có nhiều phương pháp điều chế este, được phân loại theo loại như este rượu, este phenol và este chưa bão hòa.
7.1. Este của rượu
– Phương pháp phổ biến để điều chế este của rượu là thực hiện phản ứng este hóa bằng cách đun nóng rượu với axit hữu cơ, sử dụng H2SO4 đậm đặc làm xúc tác.

– Phản ứng este hóa là phản ứng thuận nghịch. Để nâng cao hiệu suất phản ứng thuận cần điều chỉnh điều kiện phản ứng.
- Tăng nồng độ của các chất phản ứng.
- Giảm nồng độ của sản phẩm bằng cách: đun nóng để làm bay hơi este hoặc sử dụng H2SO4 đậm đặc để vừa đóng vai trò xúc tác vừa nâng cao hiệu suất phản ứng.
7.2. Este của phenol
– Este có gốc phenyl không thể điều chế được bằng cách cho axit cacboxylic và phenol phản ứng mà phải dùng axit anhydrit hoặc axit clorua để phản ứng với phenol.
(CH3CO)2O + C6H5OH → CH3COOC6H5 + CH3COOH
8. Bài tập liên quan đến este
Câu 1: Phương pháp điều chế este từ rượu phổ biến là:
A. Đun nóng rượu với axit hữu cơ, dùng H2SO4 đậm đặc làm xúc tác.
B. Tham gia vào quá trình xà phòng hóa.
C. Dùng axit anhydrit tác dụng với rượu.
D. Thực hiện phản ứng khử.
Đáp án đúng: A. Cho rượu hồi lưu với axit hữu cơ, dùng H2SO4 đậm đặc làm xúc tác.
Câu 2: Trong phản ứng este hóa giữa rượu và axit hữu cơ, khi nào cân bằng chuyển dịch theo hướng tạo este:
A. Khi còn dư cồn hoặc axit hữu cơ.
B. Khi giảm nồng độ rượu hoặc axit hữu cơ.
C. Khi sử dụng thiết bị hút nước hoặc tách nước. Chưng cất ngay để tách este.
D. Cả hai phương pháp A và C
Đáp án đúng: D. Cả hai phương án A và C
Chúng ta sẽ sử dụng các phương pháp sau:
- Thêm rượu dư thừa hoặc axit hữu cơ
- Áp dụng chất hấp thụ nước hoặc tách nước. Chưng cất ngay để tách este
Câu 3: Phương pháp nào sau đây điều chế etyl axetat trong phòng thí nghiệm là đúng:
A. Đun nóng hỗn hợp etanol, giấm và axit sunfuric đậm đặc.
B. Đun sôi hỗn hợp axit axetic, rượu trắng và axit nitric đậm đặc.
C. Đun sôi hỗn hợp etanol, axit axetic và axit sunfuric đậm đặc trong cốc chịu nhiệt.
D. Cho hỗn hợp etanol, axit axetic và axit sunfuric đậm đặc chảy ngược lại.
Xem thêm : Ý nghĩa phong thủy của hoa Mẫu Đơn và các loại hoa Mẫu Đơn
Đáp án đúng: D. Cho hỗn hợp etanol, axit axetic và axit sunfuric đặc chảy ngược lại.
Trong quá trình này, axit sulfuric đậm đặc đóng vai trò là chất xúc tác, trong khi hai hợp chất còn lại tham gia phản ứng chính.
Câu 4: Khi đốt cháy m(g) este X mạch hở thu được 0,4 mol CO2 và 5,4 g H2O. 1 mol X làm mất màu dung dịch chứa 160 g Br2. 1 mol X thủy phân đủ 1 mol kiềm thì sản phẩm thủy phân có thể tham gia phản ứng phủ bạc. Xác định công thức phân tử và công thức cấu tạo của X.
Hướng dẫn giải pháp:
1 mol X làm mất màu 1 mol Br2 => X chứa 1 liên kết đôi
1 mol X thủy phân đủ 1 mol NaOH => X là este đơn chức
=> Công thức phân tử của este X là: CnH2n-2O2
Ta có: nC : nH = n : (2n – 2) = 0,4 : 0,6 => n = 4
=> Công thức phân tử của X là: C4H6O2
X thủy phân tạo thành sản phẩm có khả năng tham gia phản ứng phủ bạc
Trường hợp 1: X là este của axit formic => CTCT của X có thể là: HCOOCH=CH-CH3 hoặc HCOOC(CH3)=CH2
Trường hợp 2: Nếu X thủy phân tạo thành aldehyd => CTCT của X là: CH3COOH=CH2
=> Có 3 CTCT của X phù hợp với bài toán: HCOOCH=CH-CH3; HCOOC(CH3)=CH2; CH3COOCH=CH2
Câu 5: Thủy phân hoàn toàn 0,1 mol este đơn chức X trong NaOH dư thu được 19,8 g hỗn hợp 2 muối. Biết X không phản ứng với Brom. Xác định công thức phân tử và công thức cấu tạo của X.
Hướng dẫn giải pháp:
0,1 mol este đơn chức X + 0,3 mol NaOH tạo thành hỗn hợp gồm 2 muối =>
Trường hợp 1: X là este nhị chức có cấu trúc R1-OOC-R-COOR2
Tính tổng R1 + R2 = 64, X không phản ứng với Brom chứng tỏ R1 và R2 đều là nhóm bão hòa, không có cặp giá trị trùng nhau.
Trường hợp 2: X là este của phenol, có dạng RCOOC6H5
Phản ứng với 2NaOH: RCOOC6H5 + 2NaOH → RCOONa + C6H5ONa + H2O
Khối lượng muối (M) = 0,1.(R + 67) + 0.1.116 = 19,8
R = 15 tương ứng với CH3
Vậy X là: CH3COOC6H5
Tóm lại, trong bài viết về Este các bạn cần lưu ý những điểm chính như tính chất hóa học của este thông qua các phản ứng thủy phân, tính chất vật lý, phương pháp điều chế và ứng dụng của este. Hy vọng bài viết này trên Nguyễn Tất Thành giúp bạn hiểu rõ hơn. Nếu có thắc mắc hoặc góp ý vui lòng để lại bình luận bên dưới bài viết. Xin chân thành cảm ơn!
Nguồn: https://truongnguyentatthanh.edu.vn
Danh mục: Blog





