Axit cacbonic (H2CO3): Định nghĩa, tính chất, và ứng dụng
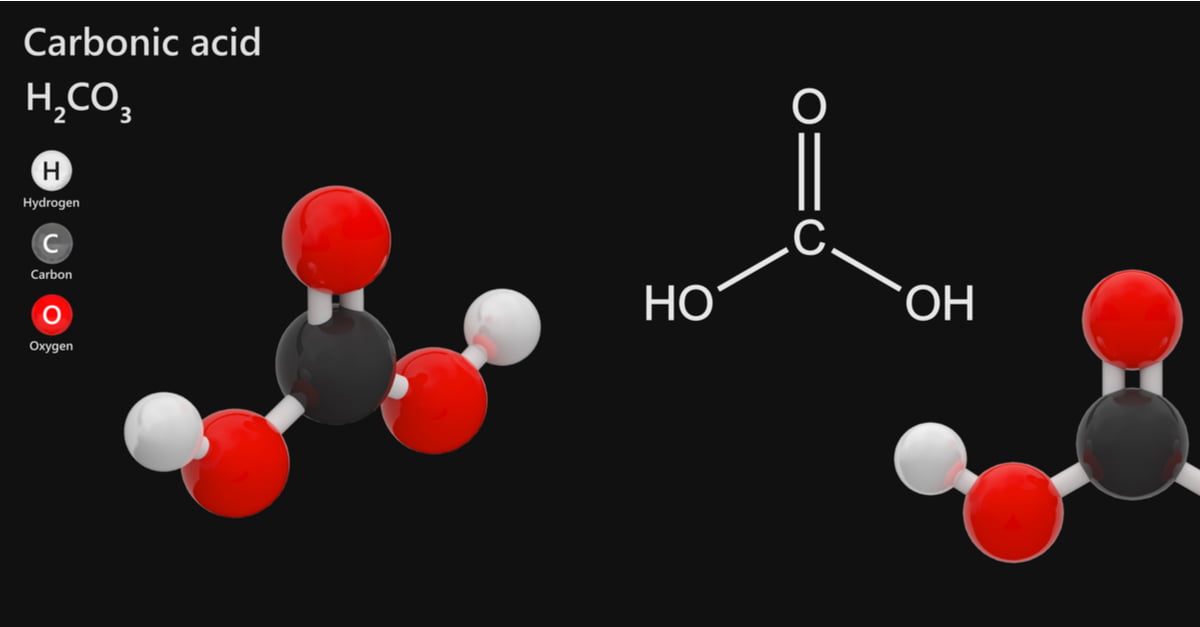
Axit carbon thường được tìm thấy trong nước của đại dương, biển, hồ, sông và nước mưa, cực kỳ phổ biến trong khí quyển. Vậy carbon dioxide là gì? Hãy tìm ra định nghĩa, thuộc tính và ứng dụng của hợp chất này.
- Hướng dẫn cách phát âm chữ O trong tiếng Việt đúng chuẩn bố mẹ cần biết để dạy cho bé
- Dầu mỏ là gì? Thành phần và những ứng dụng nổi bật
- Cách giải bài tập nhân số đo thời gian với một số từ A – Z
- Top 10+ app học tiếng anh giao tiếp miễn phí nạp từ vựng dễ dàng
- Danh từ của decide là gì? Word Families của decide và cách dùng?
Định nghĩa của axit carbon dioxide là gì?
Carbon dioxide là một hợp chất vô cơ với công thức hóa học H2CO3. Đôi khi, nó còn được gọi là dung dịch carbon dioxide trong nước, bởi vì nó chứa một lượng nhỏ H2CO3. Carbon dioxide tạo thành hai loại muối, carbonate và bicarbonate.
Công thức hóa học của carbon dioxide là: H2C03
Trọng lượng phân tử: 62,03 g/mol
Axit carbon lần đầu tiên được các nhà khoa học biết đến trong nước khoáng vì vị chua. Năm 1597, Andreas Libavius đã xuất bản trong luận án của ông về carbon dioxide. Johan Baptista van Helmont đã báo cáo chi tiết về quá trình lên men và ảnh hưởng của axit khoáng trên đá carbon.
Axit carbonic được hình thành bởi carbon dioxide và nước. Carbon dioxide chỉ xảy ra thông qua muối (carbonate), muối axit (hydro cacbonat), amino (axit carbamic) và axit clorua (carbonyl clorua) (lưới) (Mesh, 1991).
Trạng thái tự nhiên và tính chất vật lý của carbon dioxide
Carbon dioxide được tìm thấy trong Đá và hang động, trong than, thiên thạch, núi lửa, mưa axit, nước ngầm, đại dương, biển, hồ, sông và thực vật. H2CO3 cũng được tìm thấy trong cơ thể con người. CO2 trong máu kết hợp với nước tạo thành carbon dioxide, sau đó thở ra dưới dạng phổi. Ngày nay, carbon dioxide cũng được sử dụng trong nhiều loại đồ uống, như cola.

Khi thực hiện phản ứng cho CO2 hòa tan trong nước đủ với công thức V (CO2)/ V (H2O) = 9/100, mọi người quan sát hiện tượng: Khi trời mưa, nước sẽ tự động hoạt động. Được sử dụng với không khí có sẵn và hòa tan tạo ra CO2. Đổi lại, cho nước trung hòa một lượng CO2 với tỷ lệ nước/khí là 10/9. Thống kê từ các thí nghiệm này cho thấy rằng mọi dịch chuyển khí sẽ tạo ra một ML dung dịch H2CO3. Quá trình này được tăng tốc khi chúng ta làm nóng dung dịch trong quá trình phản ứng.
Do đó, chúng tôi kết luận rằng: khi trời mưa, một lượng H2CO3 đã được tạo ra và trộn lẫn trong không khí.
- CO2 hòa tan trong nước mưa và nước tự nhiên: Khoảng 1000 cm3 CO2 hòa tan 90 cm3 khi CO2.
- Một phần của CO2 hoạt động với nước để tạo thành axit carbonic, hầu hết CO2 còn lại vẫn tồn tại trong khí quyển.
- Axit carbonic chỉ tồn tại trong dung dịch nước, nó không thể cô lập các hợp chất tinh khiết.
Tính chất hóa học của carbon dioxide
Axit carbonic (H2CO3) có đặc điểm của axit nhưng ở dạng rất yếu, khiến hải quỳ màu tím chuyển sang màu đỏ nhạt.
H2CO3 là một axit không ổn định khó có thể sống sót trong không khí. Trong điều kiện bình thường, axit carbon được hình thành trong các phản ứng hóa học ngay lập tức bị phân hủy thành CO2 và nước theo phương trình: H2CO3 → CO2 + H2O

Là một axit lưỡng cực, carbon dioxide có thể tạo thành hai loại muối, carbonate và bicarbonate. Việc bổ sung một cơ sở cho dư thừa carbon dioxide sẽ tạo ra muối bicarbonate, trong khi việc bổ sung cơ sở bổ sung vào carbon dioxide sẽ tạo ra muối carbonate (theo Trung tâm thông tin công nghệ sinh học quốc gia, 2017).
Carbon dioxide là một chất không được coi là độc hại hoặc nguy hiểm. Tuy nhiên, nếu tiếp xúc với nồng độ cao có thể gây kích ứng mắt và hô hấp.
Làm thế nào để chuẩn bị carbon dioxide?
Carbon dioxide là một axit rất yếu và nó gần như không tồn tại lâu.
Mọi người chuẩn bị carbon dioxide bằng cách đưa ra phản ứng CO2 với nước theo phương trình sau:
H2O + CO2 → H2CO3

Xem thêm:
Áp dụng carbon dioxide trong tự nhiên và cuộc sống
Với tính chất vật lý và hóa học của nó, carbon dioxide được áp dụng như thế nào trong tự nhiên và sự sống?

- Trong tự nhiên, H2CO3 có thể hòa tan đá vôi, dẫn đến sự hình thành canxi bicarbonate Ca (HCO3) 2. Đây là lý do tạo ra nhiều đặc điểm của đá vôi như nhũ đá và nhũ đá.
- Trong cuộc sống, carbon dioxide (H2CO3) cũng được sử dụng trong nhiều loại đồ uống có ga như Cola.
- Carbon dioxide cũng được tìm thấy trong thực phẩm lên men dưới dạng chất thải được tạo ra bởi vi khuẩn thực phẩm (theo Michelle McGuire trong Khoa học Dinh dưỡng). Ví dụ về thực phẩm lên men ăn nước tương, súp miso, dưa cải bắp, kim chi và sữa chua. Những thực phẩm này chứa vi khuẩn có lợi có thể kiểm soát các vi sinh vật có thể gây ra các bệnh đường ruột và cải thiện việc sản xuất vitamin B12 và K.
- Carbon dioxide đóng vai trò trong tính axit cao của soda, nhưng hàm lượng đường và axit photphoric tinh chế là nguyên nhân chính của tính axit trên.
- Ngoài ra, H2CO3 cũng được sử dụng trong nhiều lĩnh vực khác như dược phẩm, mỹ phẩm, phân bón, chế biến thực phẩm, gây mê, v.v.
Tập thể dục trên axit carbon hóa học 9 với các giải pháp
Vì vậy, chúng tôi đã hiểu kiến thức cơ bản về carbon dioxide. Hãy áp dụng kiến thức đã học ở trên để thực hành bài tập sau:

Tập thể dục trên carbon dioxide (trang 91 SGK Hóa học 9)
Lấy một ví dụ rằng H2CO3 là một axit yếu hơn HCl và axit không ổn định.
Giải pháp:
Axit HCl hoạt động với muối carbonate để tạo thành axit carbon dioxide.
Xem thêm : Cách tính diện tích hình thang lớp 5 & bài tập có cách giải chi tiết
2HCl + Na2Co3 → 2NaCl + H2CO3
H2CO3 là một axit không ổn định, bị phân hủy ngay lập tức cho CO2 và H2O, do đó, phương trình được viết là:
2HCl + Na2Co3 → 2NaCl + CO2 + H2O.
|
Xây dựng một nền tảng toán học vững chắc cho trẻ em từ khi còn nhỏ với đa phương tiện, cực kỳ rẻ có giá dưới 2k/ngày với toán học khỉ.
|
Bài tập axit carbon tự sinh
Ngoài các bài tập trong sách giáo khoa, những điều sau đây sẽ là một số bài tập liên quan để họ áp dụng lý thuyết và thực hành cùng nhau:
Câu 1: Điều nào sau đây là muối axit?
A. Nahco3, Baco3, NA2CO3.
B. BA (HCO3) 2, NAHCO3, CA (HCO3) 2.
C. CA (HCO3) 2, BA (HCO3) 2, MGCO3.
D. Mg (HCO3) 2, BA (HCO3) 2, Caco3.
Trả lời: b
Câu 2: Trình tự muối được hòa tan trong nước
A. Caco3, MGCO3, MG (HCO3) 2, K2CO3.
B. Caco3, Nahco3, MG (HCO3) 2, NA2CO3.
C. Caco3, Na2Co3, Nahco3, MGCO3.
D. NA2CO3, CA (HCO3) 2, BA (HCO3) 2, K2CO3.
Trả lời: d
Câu 3: Trình tự các chất bị phân hủy bởi nhiệt là
A. NA2CO3, MG (OH) 2, CA (HCO3) 2, Baco3.
B. MGCO3, Baco3, CA (HCO3) 2, NAHCO3.
C. K2CO3, KOH, MGCO3, CA (HCO3) 2.
D. NAHCO3, KHCO3, NA2CO3, K2CO3.
Trả lời: b
Câu 4: Trình tự các chất phản ứng với dung dịch HCl ở điều kiện bình thường
A. NA2CO3, Caco3.
B. K2SO4, NA2CO3.
C. Na2SO4, Mg (NO3) 2.
D. Na2SO3, Kno3.
Trả lời: a
Na2Co3 + 2HCl → 2NaCl + CO2 + H2O
Caco3 + 2HCl → CaCl2 + CO2 + H2O
Câu 5: Cặp nào sau đây có thể cùng tồn tại trong giải pháp?
A. HCL và KHCO3.
Xem thêm : Toán lớp 2 lít: Định nghĩa, các dạng bài tập và bí quyết học hiệu quả
B. CA (OH) 2 và CA (HCO3) 2.
C. K2CO3 và CaCl2.
D. K2CO3 và NA2SO4.
Trả lời: d
Dung dịch K2CO3 không phản ứng với dung dịch Na2SO4.
Câu 6: Cho 4 gram CACO3 với lượng dung dịch HCl đủ 2M. Khối lượng của giải pháp HCl được sử dụng là:
A. 0,05 lít.
B. 0,04 lít.
C. 0,75 lít.
D. 0,15 lít.
Trả lời: b
Câu 7: Cho phương trình hóa học sau: X + NaOH → NA2CO3 + H2O. X là
AC
B. Nahco3.
C. đồng.
D. KHCO3.
Trả lời: b
Nahco3 + NaOH → NA2CO3 + H2O
Câu 8: Khối lượng kết tủa được tạo ra, khi 10,6 gram Na2CO3 hoạt động vừa đủ với dung dịch Ca (OH) 2.
A. 5 gram.
B. 10 gram.
C. 15 gram.
D. 20 gram.
Trả lời: b
Câu 9: Có 2 giải pháp K2SO4 và K2CO3 Thuốc thử nào sau đây có thể xác định hai giải pháp trên?
A. Dung dịch BACL2.
B. Giải pháp HCl.
C. dung dịch NaOH.
D. Giải pháp PB (NO3) 2.
Trả lời: b
Câu 10: Hoàn toàn làm nóng hỗn hợp muối Caco3 và MgCO3 để thu được 76 gram hai oxit và 33,6 lít CO2 (DKTC). Lượng hỗn hợp muối ban đầu là
A. 142 gram.
B. 124 gram.
C. 141 gram.
D. 140 gram.
Trả lời: a
Bài viết trên đã cung cấp cho bạn tất cả các kiến thức quan trọng như định nghĩa, tính chất và ứng dụng của carbon dioxide (H2CO3) – một hợp chất vô cơ cực kỳ phổ biến trong cuộc sống. Hy vọng rằng kiến thức này sẽ hữu ích cho quá trình học tập của bạn. Vui lòng chia sẻ nếu bạn thấy bài viết hữu ích và đừng quên truy cập trang web của Nguyễn Tất Thành hàng ngày để tham khảo thông tin thú vị hơn về hóa học.
Nguồn: https://truongnguyentatthanh.edu.vn
Danh mục: Giáo dục






