Ankadien: Hướng dẫn lý thuyết và giải bài tập chi tiết
Alkadien tạo ra nhiều hợp chất có tính đàn hồi cao như cao su có ứng dụng quan trọng trong nhiều lĩnh vực của đời sống. Vậy Ankadien là gì? Hãy cùng tìm hiểu về khái niệm, tính chất hóa học và phương pháp điều chế alkadien qua bài viết dưới đây.
Định nghĩa của alkadien là gì?
Alkadienes được định nghĩa là hydrocarbon không bão hòa mạch hở. Phân tử hợp chất này chứa 2 liên kết đôi.
Bạn đang xem: Ankadien: Hướng dẫn lý thuyết và giải bài tập chi tiết
CH2 = C = CH2: Propadien
CH2 – C = CH – CH3: buta -1,2 – diene
CH2 = CH – CH = CH2: buta -1,3 – diene
Phân loại alkadien
Dựa vào vị trí tương đối giữa hai liên kết đôi, có thể chia Alkadiene thành 3 loại:

Công thức chung của Alkadiene liên hợp là gì? Alkadien liên hợp có công thức chung CnH2n-2 (có n ≥ 4).
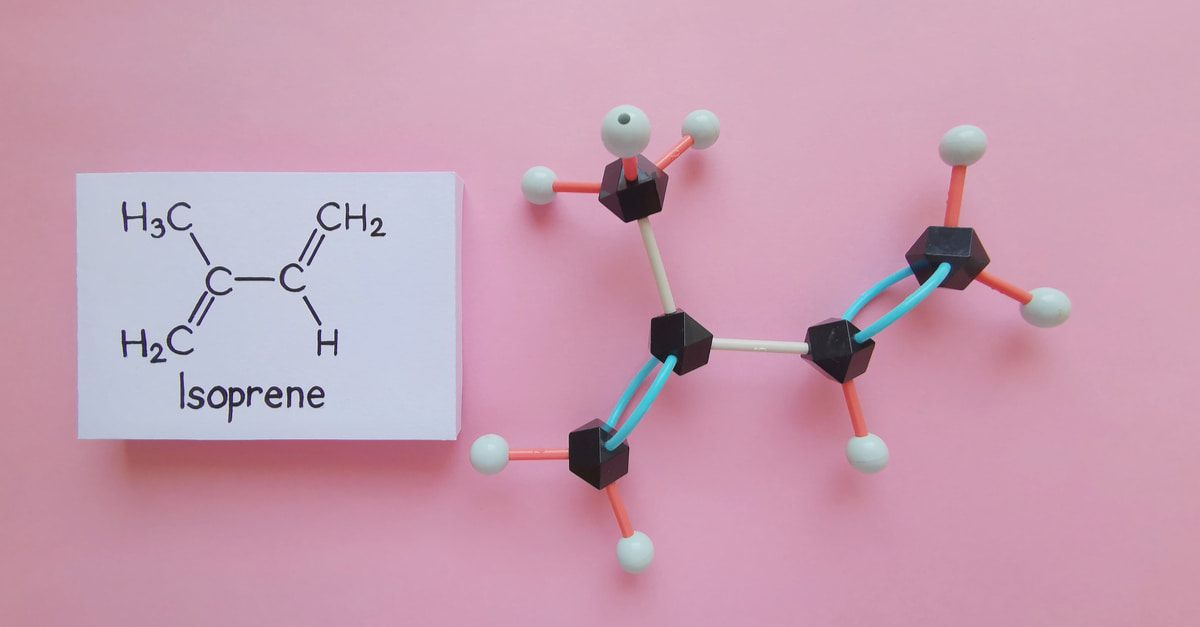
Ví dụ: Các alkadien liên hợp như bita-1,3diene CH2=CH-CH=CH2 và isopren CH2=C(CH3)-CH=CH2 thường được nhắc đến với nhiều ứng dụng thực tế.
Butadien: CH2 = CH-CH = CH2
Isopren: CH2 = C – CH = CH2
|
CH3
3 tính chất hóa học quan trọng của alkadien
Những tính chất hóa học quan trọng của alkadien mà bạn cần nhớ là gì? Chúng ta hãy tìm hiểu về 3 tính chất đặc trưng của alkadien thông qua: Phản ứng cộng, phản ứng trùng hợp halogen và phản ứng oxy hóa halogen.

Phản ứng cộng của alkadien
Tương tự như anken, buta-1,3-diene có thể tham gia phản ứng cộng với hydro (với sự có mặt của chất xúc tác niken), halogen và hydro halogenua. Tùy theo điều kiện, phản ứng sẽ xảy ra ở một trong hai liên kết đôi (cộng 1,2) hoặc cộng vào đầu ngoài của hai liên kết đôi (cộng 1,4) hoặc cộng vào hai liên kết đôi cùng một lúc. .
Thêm hydro
CH2=CH – CH=CH2 + 2H2 → CH3 – CH2 – CH2 – CH3 (Ni, nhiệt độ)
Thêm brom
Alkadien + br2 có khả năng cộng 1,2 ở -80oC và cộng 1,4 ở 40oC.
CH2=CH – CH=CH2 + Br2 (dd) → CH2=CH-CHBr-CH2Br (-80 độ C)
CH2=CH-CH=CH2 + Br2 (dd) → CH2Br – CH=CH-CH2Br (40 độ C)
CH2=CH – CH = CH2 + 2Br2 (dd) → CH2Br – CHBr – CHBr – CH2Br
Thêm hydro halogen
CH2 = CH – CH = CH2 = HBr → CH2 = CH – CHBr – CH3 (-80 độ C)
CH2 = CH – CH = CH2 + HBr → CH3 – CH = CH – CH2Br (40 độ C)
(sản phẩm chính)
Phản ứng trùng hợp halogen
Khi có mặt kim loại natri hoặc chất xúc tác, buta-1,3-diene sẽ tham gia phản ứng trùng hợp, chủ yếu ở mode 1,4:
Xem thêm : Ankan: Định nghĩa, tính chất, ứng dụng và cách điều chế
nCH2=CH-CH=CH2 → (-CH2-CH=CH-CH2-)n (polobutaddien) Điều kiện: Nhiệt độ, p, chất xúc tác.
Phản ứng oxy hóa halogen
Trong tính chất hóa học của alkadien, phản ứng oxy hóa halogen cũng là một tính chất quan trọng, bao gồm: Phản ứng oxy hóa hoàn toàn và phản ứng oxy hóa không hoàn toàn.
-
Phản ứng oxy hóa hoàn toàn
Ví dụ: 2C4H6 + 11O2 → 8CO2 + 6H2O (nhiệt độ)
-
Phản ứng oxy hóa không hoàn toàn
Tương tự như anken, Buta-1,3-diene và isoprene cũng làm mất màu dung dịch thuốc tím KMnO4.
2 cách điều chế alkadien
Có hai phương pháp chính điều chế alkadien:

CH3 – CH2 – CH2 – CH3 → CH2=CH-CH=CH2 + 2H2 (nhiệt độ, chất xúc tác)
CH3 – CH(CH3) – CH2 – CH3 → CH2 = C (CH3) – CH = CH2 + 2H2 (xúc tác, nhiệt độ)
Sơ đồ tóm tắt kiến thức về alkadien

Ứng dụng của alkadien trong đời sống
Đối với các ứng dụng của alkadien, các alkadien liên hợp như buta-1,3diene CH2=CH-CH=CH2 và isopren CH2=C(CH3)-CH=CH2 có nhiều ứng dụng thực tế. Nhờ phản ứng trùng hợp đặc hiệu, hai hợp chất này có thể điều chế được polybutadien hoặc pollosprene là những chất có tính đàn hồi cao, dùng để sản xuất cao su như cao su buna, cao su isopren… cao su buna. Được sử dụng trong sản xuất lốp xe và chất bịt kín thuyền.
Xem thêm:
Bài tập về alkadien SGK Hóa học lớp 11 có lời giải chi tiết
Các bài tập Hóa học lớp 11 dưới đây sẽ giúp người đọc nắm chắc lý thuyết và ôn tập sâu kiến thức về ankadienes thông qua hướng dẫn giải bài tập bằng phương pháp giải đúng và ngắn gọn nhất.
.jpg)
Giải bài 1 trang 135 SGK Hóa 11
Alkadiene và alkadiene liên hợp là gì? Viết công thức cấu tạo và gọi tên các ankađien liên hợp có công thức phân tử C4H6, C5H8
Câu trả lời được đề xuất:
Định nghĩa :
-
Alkadienes là hydrocacbon mạch hở có hai liên kết đôi C=C trong phân tử.
-
Các alkadien có hai liên kết đôi cách nhau bởi một liên kết đơn được gọi là các alkadien liên hợp.

Giải bài 2 SGK Hóa 11 trang 135
Viết phương trình hóa học (ở dạng công thức cấu tạo) của các phản ứng xảy ra khi:
Một. Isopren phản ứng với hydro (xúc tác Ni)
b. Isopren phản ứng với brom trong (trong CCl4) Các chất được lấy theo tỉ lệ mol 1:1 để tạo ra sản phẩm cộng 1, 4.
c. Phản ứng trùng hợp isopren tuân theo chế độ 1,4.
Câu trả lời được đề xuất:

Giải bài 3 SGK trang 135 Hóa 11
Xem thêm : Tổng hợp 100+ Từ vựng tiếng Anh chủ đề nhà cửa cho bé
Oxi hóa hoàn toàn 0,680 gam alkadien X thu được 1,120 lít CO2 (điều kiện tiêu chuẩn)
Một. Tìm công thức phân tử của X
b. Tìm công thức cấu tạo có thể có của X
Câu trả lời được đề xuất:
Một. Gọi CTPT của alkadien X CnH2n-2 (n ≥ 3)
nCO2 = 1,12/ 22,4 = 0,05mol
CnH(2n-2) + (3n-1)/2 x O2 → NCO2 + (n-1)H2O
Theo PT: (14n-2) gn mol
Theo bài toán: 0,68 0,05mol
⇒ (14n-2).0,05 = 0,68.n ⇒ n = 5 ⇒ CTPT X: C5H8
b. CTCT có thể có của X là:
CH2=C=CH-CH2-CH3
CH2=CH-CH=CH-CH3
CH2=CH-CH2-CH=CH2
CH3-CH=C=CH-CH3
CH2= C(CH)-CH = CH2
Giải bài 4 trang 135 SGK Hóa 11
Khi buta-1,3-diene phản ứng với H2 ở nhiệt độ cao, với Ni làm chất xúc tác có thể thu được
A. Butan; B. Isobutan; C. Isobutilen ; D. Pentan
Giải: Đáp án A
PTHH: CH2=CH-CH=CH2 + 2H2 → CH3-CH2-CH2-CH3 (Ni, nhiệt độ)
Giải bài 5 SGK Hóa 11 trang 136
Hợp chất nào sau đây kết hợp với H2 tạo thành isopentane?

Đáp án gợi ý: Đáp án B
PTHH:
CH2=CH-C(CH3)=CH2 + 2H2 → CH3-CH2-CH(CH3)-CH3 (Ni, nhiệt độ)
Trên đây là những kiến thức cơ bản và quan trọng nhất về alkadien, bao gồm: Ankadiene là gì, phân loại, tính chất, điều chế và ứng dụng của chúng. Nguyễn Tất Thành chúc các bạn có thể vận dụng tốt những kiến thức thú vị này vào các bài tập thực hành môn Hóa cũng như trong đời sống thực tế. Hãy nhấn vào GET UPDATES ở đầu trang để không bỏ lỡ những thông tin hữu ích khác về Hóa học nhé!
Nguồn: https://truongnguyentatthanh.edu.vn
Danh mục: Giáo dục



![[GIẢI ĐÁP] Chứng chỉ IELTS có được miễn thi tốt nghiệp không?](https://truongnguyentatthanh.edu.vn/wp-content/uploads/GIAI-DAP-Chung-chi-IELTS-co-duoc-mien-thi-tot-800x450.jpg)

